无机化学
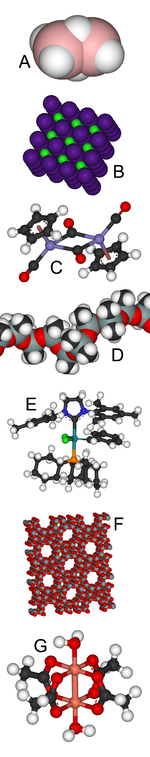
复杂多样的无机化合物:
A:乙硼烷中含有不寻常的三中心两电子键。
B:氯化铯的晶体结构是一类结构的代表。
C:Fp2是一个有机金属双核簇合物。
D:硅氧树脂在隆胸技术和橡皮泥中都有应用。
E:格拉布催化剂的发现者凭此获得了2005年的诺贝尔化学奖。
F:沸石是分子筛的一种重要类型。
G:乙酸铜异常的逆磁性质为理论化学增添了新的动力。
无机化学是研究无机化合物的化学分支学科。通常,无机化合物与有机化合物相对,指不含C-H键的化合物,因此一氧化碳、二氧化碳、二硫化碳、氰化物、硫氰酸盐、碳酸及碳酸盐等都属于无机化学研究的范畴。但这二者界限并不严格,之间有较大的重叠,有机金属化学即是一例。
目录
1 历史
2 基本概念
3 合成方法
4 无机化合物
4.1 配位化合物
4.2 主族元素化合物
4.3 过渡金属化合物
4.4 有机金属化合物
4.5 原子簇化合物
4.6 生物无机化合物
4.7 固相化合物
5 理论无机化学
5.1 定性理论
5.2 分子对称性与群论
6 热动力学和无机化学
7 动力学的无机化学
8 参考文献
9 外部链接
10 参见
历史
由于在有机化学发展初期,所有有机化合物(如尿素和尿酸等)都是从生物体内取得的,而且它们的性质类似,因此取“有机化学”作为其名称。其中的“机”字带有“机体”,“身体”的意思。而与之相对便诞生了“无机化学”,用以指研究非生物体化合物的化学,当时主要包含从矿物如雄黄和方铅矿中制得的化合物。然而,随着1828年弗里德里希·维勒成功由无机的氰酸铵NH4OCN{displaystyle {ce {NH4OCN}}}

- 无机含碳的化合物有:二元碳氧化物、碳酸、二元碳硫化物、金属羰基化合物、碳卤化物、氰化物、氰酸盐、异氰酸盐、雷酸盐、硫氰酸盐、碳化物、光气、硫光气、简单的卤代和氰代烃,以及诸如三甲基胂之类的有机金属化合物等。而
- 有机不含碳的化合物有:很多13-17族的与烷烃类似的元素氢化物及衍生物,尤其是硅烷和肼及其相应的衍生物。
基本概念

離子晶體氧化鉀K2O的結構
許多無機化合物是離子化合物,由陽離子和陰離子以離子鍵結合。像氯化鎂MgCl2{displaystyle {{ce {MgCl2}}}}




無機鹽類中重要的有氧化物、碳酸鹽、硫酸鹽及鹵化物等。無機鹽類一般有很高的熔點,在固態時多半不是電的良導體,其他的特徵包括對水的溶解度(參見溶解性表)及容易结晶的程度。不過有些無機鹽類(像氯化鈉)可以在水中溶解,有些(像二氧化矽)則不行。
最簡單的無機化學反應為复分解反应,在混合二種鹽類時,其離子互換,但氧化態不變。在氧化還原反應中,還原劑的氧化態增加,而氧化劑的氧化態降低。淨反應是電子的轉移。電子的轉移也可以以間接的方式產生,例如在電池中的反應一様,這也是电化学的基礎概念。
當反應物中有可以解離的氫離子時,會產生交換質子(氫離子)的酸碱反應。釋放質子的是酸,接收質子的是碱。路易士酸鹼理論是較廣義的酸鹼定義,其中可以和電子對結合的稱為路易士酸,可以提供電子對的稱為路易士碱。软硬酸碱理论除了將化合物分為酸和鹼,也依極化程度及離子大小來分類[2]。
自然界中許多的無機化合物都是礦物。像土壤中含有氧化鐵(黄铁矿)及硫酸鈣(石膏)。許多無機化合物也是生物分子,有許多不同的作用,例如電解質(氯化鈉)及結構(像DNA中的多磷酸結構)。
第一個重要的人造化合物是硝酸銨,利用哈柏法製備。許多無機化合物可作為觸媒(像五氧化二釩及三氯化鈦)或是有機化學中的反應物,像氫化鋁鋰。
无机化学的分支包括有機金屬化學、原子簇化學及生物无机化学。這些也是无机化学的熱門研究領域,主要要找到新的觸媒、超導體及藥物。
合成方法
無機化合物的合成方法大多數都採用以下方式:
- 分解反应
- 化合反应
- 置换反应
- 复分解反应
无机化合物
无机化合物常会因性质的不同而被分到不同的类别,有时是以化合物最重元素在元素周期表中的位置,有时则以该化合物与其它在结构上的相似性来分类。但这些分类并不是绝对的,它们之间有重叠。
配位化合物

[Co(EDTA)]−中,Co3+离子被EDTA八面体型螯合。
以经典配位化学理论的角度来看,主族元素构成的配体(如H2O{displaystyle {ce {H2O}}}

配位化合物的异构现象十分普遍。维尔纳在1914年合成并且而后光学拆分的Hexol([Co((OH)2Co(NH3)4)3]6+{displaystyle {ce {[Co((OH)2Co(NH3)4)3]^6+}}}![{displaystyle {ce {[Co((OH)2Co(NH3)4)3]^6+}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/c39d8d38aea23dc1302f9ecdfa8437ed88446ba1)
例* 子:[Co(EDTA)]−、[Co(NH3)6]3+、TiCl4(THF)2。
主族元素化合物

四氮化四硫(S4N4)的复杂结构引发了无机化学家的兴趣。
主族元素化合物主要指1-2族(除氢之外)和13-18族元素形成的化合物,有时3族的Sc、Y和La及12族的Zn、Cd和Hg也因为反应性类似而被包含在内。[5]
很多主族元素化合物自从化学被发现之初便被研究,例如很多单质硫、白磷和氧气的二元化合物,以及卡尔·博施和弗里茨·哈伯在二十世纪初发明的合成氨技术更是极大地激励了无机合成化学的发展。
典型的主族元素化合物有:SiO2、SnCl4和N2O。它们之中有很多都可被归为“有机金属化合物”的范畴,例如B(CH3)3,由于其分子中含有有机基团的缘故。很多主族元素化合物也存在于自然界中——例如体液中的离子、DNA中的磷酸基团以及许多酶中的中心金属原子,而它们也因此被划在“生物无机化学”的范围之下。相反地,某些缺少氢的有机化合物也可被划分为无机化合物,比如富勒烯、碳纳米管和二元碳氧化物。
- 例子:四氮化四硫S4N4{displaystyle {ce {S4N4}}}
、乙硼烷B2H6{displaystyle {ce {B2H6}}}
、硅氧树脂、富勒烯C60{displaystyle {{ce {C60}}}}
。
过渡金属化合物

聚酞菁铜是与血红素相关的过渡金属化合物。
过渡金属化合物包含的是4-11族元素所形成的化合物。尽管有时也会考虑3族和12族的元素,但一般主要认为它们属于主族元素化合物的范畴。
过渡金属配合倾向很强,其化合物构型也有很大不同,从钛的四面体型(例如TiCl4{displaystyle {{ce {TiCl4}}}}
- 例子:五羰基铁Fe(CO)5{displaystyle {{ce {Fe(CO)5}}}}
、TiCl4、顺铂cis-Pt(NH3)2Cl2{displaystyle {ce {Pt(NH3)2Cl2}}}
。
有机金属化合物

有机锂试剂例如n-丁基锂,常以聚合态存在。
一般把有机金属化合物定义为含有M-C-H键的化合物,[6] 其中的金属M既可以是主族元素,也可以是过渡金属。但在很多情况下有机金属化合物的范围被延伸,高度亲脂的金属羰基化合物和金属醇盐也被包含在内。
有机金属化合物之所以被单独归为一类,是因为它们中的有机基团对于氧化和水解较为敏感,且制备方法也较经典的配位化合物苛刻。很多包含弱配位能力配体(如烃类、H2和N2)的配位化合物,也成功在低配位能力溶剂中制得。
由于配体常是石化工业中的材料而且这一类化合物性质独特,有机金属化学近年来发展很快,一些例子有:
环戊二烯基羰基铁(C5H5)Fe(CO)2CH3{displaystyle {ce {(C5H5)Fe(CO)2CH3}}}、二茂铁Fe(C5H5)2{displaystyle {ce {Fe(C5H5)2}}}
、六羰基钼Mo(CO)6{displaystyle {ce {Mo(CO)6}}}
、乙硼烷B2H6{displaystyle {ce {B2H6}}}
、四(三苯基膦)钯(0)Pd[P(C6H5)3]4{displaystyle {ce {Pd[P(C6H5)3]4}}}
。
原子簇化合物
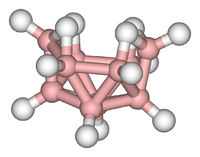
癸硼烷是一个含硼的高毒簇合物。

铁硫簇是铁硫蛋白的中心结构。
M
原子簇化合物存在于各类化合物中,通常被定义为:凡以3个或3个以上原子直接键合构成的多面体或笼为核心,连接外围原子或基团而形成的结构单元。[7]
- 例子:Fe3(CO)12、B10H14、[Mo6Cl14]2−、4Fe-4S。
生物无机化合物
- 例子:血红素、甲基汞、羧肽酶。
固相化合物
有關固相化合物的研究以其材料的結構[8]、鍵結以及物理性質為主。在實務上,固相無機化學使用像晶体学的技術來 了解固體的性質,而這些性質是固體中的許多小單位互相作用的結果。金屬、合金及金屬互化物都包括在固相化合物的研究內容中。相關的研究領域包括凝聚态物理学、冶金學及材料科學。
- 例子:硅片、沸石、YBa2Cu3O7。
理论无机化学
以原子的玻尔行星模型为起始,现在的理论无机化学以理论化学和计算化学作为基础,通过定量、半定量的计算或定性分析,得出复杂分子所应具有的性质。由于多电子体系的精确量子力学计算较困难,包括分子轨道理论和配位场理论等的半定量和半实验的方法,及密度泛函理论之类的近似方法都被应用于理论无机化学中。
除理论外,定量和定性两个概念对该领域的发展起到至关重要的作用。譬如根据晶体场理论,CuII2(OAc)4(H2O)2含有两个未成对电子,应为顺磁性,但事实上它在室温下几乎是逆磁性的。定性理论和实验之间的矛盾导致了“磁性耦合”这一概念的诞生。因此它不仅推进了自身领域的发展,也带动了新材料和新科技的诞生。
定性理论

晶体场理论解释了为何[FeIII(CN)6]3−离子只有一个未成对电子。
定性理论只需很少的量子力学基础,对于理解无机化学有很大作用。对于主族元素,价层电子对互斥理论(VSEPR)可以较好地预测分子形状,比如它可以解释为何NH3是三角锥型,而ClF3{displaystyle {ce {ClF3}}}
![{displaystyle {ce {[Fe^{III}(H2O)6]^{3+}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/a557dae9709041cb0f4de56fe17ab35fa6a8e677)
分子对称性与群论
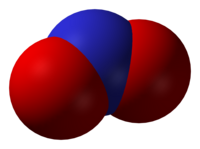
二氧化氮(NO2)展示了C2v对称
无机化学的中心结构是分子对称性理论[9]。数学中的群论提供了合适的语言依据点群对称性来描述分子的形状。群论也使得理论计算得以简化和因子化。
热动力学和无机化学
研究无机化学的另一种方法是关注反应的能量。比如氧化还原电位,酸性,相变等。
动力学的无机化学
无机化学的一个重要的也是日受关注的方面是研究反应途径。
参考文献
^ 人工合成尿素开创者 维勒. 新浪讀書. [2013-10-25].
^ 1.2.7 硬软酸碱理论(HSAB理论). 福建师范大学网络教育学院. [2013-10-25].
^ A. Werner, H. Kuh, P. Wust. Ber. 1914, 47, 196
^ Lehn, J. M., Supramolecular Chemistry: Concepts and Perspectives, VCH: Weinhiem, 1995.
^ Greenwood, N. N.; & Earnshaw, A. (1997). Chemistry of the Elements (2nd Ed.), Oxford:Butterworth-Heinemann. ISBN 978-0-7506-3365-9.
^ C. Elschenbroich, A. Salzer ”Organometallics : A Concise Introduction” (2nd Ed) (1992); Wiley-VCH: Weinheim. ISBN 978-3-527-28165-7
^ 张季爽、申成主编,湖南大学化学化工学院组编。《基础结构化学》第二版。北京:科学出版社。ISBN 7-03-016425-2
^ Wells, A.F. Structural Inorganic Chemistry. Oxford: Clarendon Press. 1984.
^ Cotton, F. A. Chemical Applications of Group Theory 3rd. New York: John Wiley & Sons. 1990. ISBN 978-0471510949.
外部链接
常见无机化学期刊的链接(英文)
参见
- 无机化合物
- 有机化学
| ||||||||||||||||||||||||||||||
|
