钍
body.skin-minerva .mw-parser-output table.infobox caption{text-align:center}
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 外觀 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
銀白色,有時會變黑失去光澤  | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 概況 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 名稱·符號·序數 | 釷(thorium)·Th·90 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 元素類別 | 錒系金屬 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
族·週期·區 | 3 ·7·f | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 標準原子質量 | 232.03806 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 電子排布 | [氡] 6d2 7s2  | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 歷史 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 發現 | Jöns Jakob Berzelius(1829年) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 物理性質 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 物態 | 固態 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 密度 | (接近室温) 11.7 g·cm−3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 熔點 | 2115 K,1842 °C,3348 °F | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 沸點 | 5061 K,4788 °C,8650 °F | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 熔化熱 | 13.81 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 汽化熱 | 514 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 比熱容 | 26.230 J·mol−1·K−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
蒸氣壓
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子性質 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 氧化態 | 4, 3, 2, 1 (弱鹼性) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 電負性 | 1.3(鲍林标度) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 電離能 | 第一:587 kJ·mol−1 第三:1930 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子半徑 | 179 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 共價半徑 | 206±6 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 雜項 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 晶體結構 | 面心立方 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 磁序 | 順磁性[1] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 電阻率 | (0 °C)147 n Ω·m | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 熱導率 | 54.0 W·m−1·K−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 膨脹係數 | (25 °C)11.0 µm·m−1·K−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
聲速(細棒) | (20 °C)2490 m·s−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 楊氏模量 | 79 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 剪切模量 | 31 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 體積模量 | 54 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 泊松比 | 0.27 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 莫氏硬度 | 3.0 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 維氏硬度 | 350 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 布氏硬度 | 400 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS號 | 7440-29-1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 最穩定同位素 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
主条目:釷的同位素
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
钍(Thorium,拼音:tǔ,舊譯作釖、鋀)是原子序数为90的元素,其元素符號為Th,屬锕系元素,具有放射性。其拉丁文名称來自北欧神话的雷神索尔(Thor)。
钍-232会通过吸收慢中子而变成可作核燃料之用的铀-233。钍、铀两种元素是核能发电厂最重要的燃料。
目录
1 历史
2 来源
2.1 分布
3 特征
4 提取
5 同位素和裂变序列
6 应用
6.1 原子工业
6.2 钍造影剂
6.3 其它应用
7 安全
7.1 放射性
8 化合物
9 参考
10 參考文獻
11 延伸閱讀
12 外部連結
历史
1828年,瑞典化学家永斯·贝采利乌斯在来自一个挪威岛屿的釷石矿中发现了新一种元素,此后以北歐神話的雷神索尔命名。1898年,玛丽亚·居里和格哈特·施密特分别并同时发现了钍的放射性。发现90年后,化学家才首次得以分离纯的钍。
来源

独居石砂
钍化物往往可以在独居石的沙裡找到((Ce,La,Nd,Th)[PO4],包含4-12%的二氧化钍,ThO2),其它矿物包括与鋯石同晶型的方釷石((Th,U)O2)和釷石(ThSiO4)。榍石和锆石也含少量钍。
在地壳里平均每千克物质含7至13毫克钍,也就是说钍是铀的含量的两至三倍。由于钍亲土,因此在所有硅酸盐中均含少量钍。
澳大利亚、挪威、斯里兰卡、加拿大、美国、印度、拉普兰和巴西开采钍。土耳其有约80亿吨未开采的矿藏。全世界年开采二氧化钍量估计为100万吨。人的骨骼中每千克骨骼质约含0.002至0.012毫克钍。每天通过食物和饮水一个人约进食0.05至3微克钍。[2]
分布
由于目前对于钍的需求不大,对于矿藏分布地區的勘探很少,因此钍资源的分布不是很清楚。[3]一般认为澳大利亚和印度有尤其多的钍矿。
- 以下数据是美国地质调查局1997年至2006年调查报告中的数据:[4][5]
| 国家 | 钍储藏(吨) | 钍储藏基础(吨) |
|---|---|---|
| 澳大利亚 | 300,000 | 340,000 |
| 印度 | 290,000 | 300,000 |
| 挪威 | 170,000 | 180,000 |
| 美国 | 160,000 | 300,000 |
| 加拿大 | 100,000 | 100,000 |
| 南非 | 35,000 | 39,000 |
| 巴西 | 16,000 | 18,000 |
| 马来西亚 | 4,500 | 4,500 |
| 其它国家 | 95,000 | 100,000 |
| 全世界总和 | 1,200,000 | 1,400,000 |
另一个估计来自于2001年经济合作与发展组织发表的数据:[6]
| 国家 | 可靠的储藏估计(吨) | 估计还有的储藏(吨) |
|---|---|---|
| 巴西 | 606,000 | 700,000 |
| 土耳其 | 380,000 | 500,000 |
| 印度 | 319,000 | - |
| 美国 | 137,000 | 295,000 |
| 挪威 | 132,000 | 132,000 |
| 格陵兰 | 54,000 | 32,000 |
| 加拿大 | 45,000 | 128,000 |
| 澳大利亚 | 19,000 | - |
| 南非 | 18,000 | - |
| 埃及 | 15,000 | 309,000 |
| 其它国家 | 505,000 | - |
| 全世界总和 | 2,230,000 | 2,130,000 |
这两组数据中对巴西、土耳其和澳大利亚的估计的差距比较大。
特征
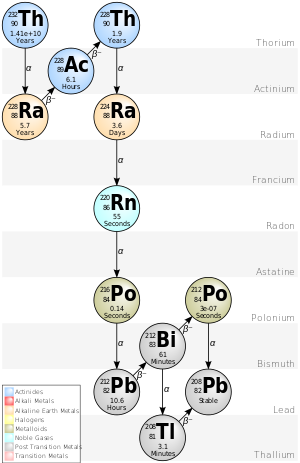
钍-232的4n衰变链, 俗称“钍系”。
纯钍是银白色的金属,在室温下在空气里它稳定,可以数月保持其金属光泽。它逐渐氧化为灰色,最后为黑色。钍的物理特性与它含多少氧化物有关。一般纯的钍含有百分之零点几的二氧化钍。但是也可以制造极纯的钍。纯钍柔软,延展性能很好,可以冷压滚和拉长。钍具有多晶型性,有两个不同的晶态。在摄氏1400度以上它是面心立方的,在这个温度以下它是体心立方的。水对钍的腐蚀作用很慢。在大多数稀酸里以及在浓盐酸和磷酸里它的溶解速度也很慢。在发烟硝酸和王水中它溶解迅速。粉状或者屑状的钍在空气里加温下很容易自燃。其火焰是白色、明亮的。
提取
钍是从氧化钍中提取出来的。在氩空气中或者在真空中氧化钍被钙在高温下还原。由于钍会与氢组成化合物因此无法使用氢来还原。还原后使用氟化氢冲洗,然后钍被过滤出来。
同位素和裂变序列
在自然界中钍只有一种同位素232Th,它是所有同位素中半衰期最长的。长时间里人们以为以下这个衰变系列是从钍232Th开始的,因此它也被称为钍衰变系列:
镭Ra-228(半衰期5.75年)
锕Ac-228(6.15小时)- 钍Th-228(1.9116年)
- 镭Ra-224(3.66日)
氡Rn-220(55.6秒)
钋Po-216(0.145秒)
铅Pb-212(10.6小时)
铋Bi-212(60.55分钟)- 64%钋Po-212(3·10−7秒)和
- 36%铊Tl-208(3.053分钟)
- 两者皆衰变为稳定的铅Pb-208
应用
钍的氧化物被用来制作白炽罩。这样的白炽罩是将布料浸在99%的硝酸钍和1%的硝酸铈溶液中然后点燃制成的。在高温下硝酸钍分解为氧化钍和氧化氮[何意?]。由于钍的放射性,现在已经不再使用钍来做白炽罩了。
原子工业
在球床反應堆如THTR-300中钍可以用来制作铀同位素233U:通过中子射击钍232Th可以变成233Th,后者通过镤233Pa衰变为铀233U。铀的这个同位素可以裂变,当作核电站的燃料使用。由于钍比铀常见得多,因此假如未来铀矿逐渐消耗的话钍可能成为重要的能源来源。今天要经济地使用这个工艺还需要解决许多技术和安全问题。
232Th +n⟶233Th⟶β−22,3min 233Pa⟶β−26,967d 233U{displaystyle mathrm {{}^{232}Th +nlongrightarrow {}^{233}Th{stackrel {beta ^{-}22,3min}{longrightarrow }} {}^{233}Pa{stackrel {beta ^{-}26,967d}{longrightarrow }} {}^{233}U} }
公式里的时间数据是半衰期
比起铀235U和钚239Pu钍有一个重要的优点:它每吸收一个中子的产量高。它的生产效率比目前使用的238U和239Pu還要高。
这个技术价格高的原因之一是因为产生的233U中掺有半衰期很短的232U,使得它的放射性非常高。此外在回收钍的时候也有类似的毛病,因为其中掺有放射性高的228Th。除此之外生产233U有导致核武器扩散的危险。
1960年代里美国橡树岭国家实验室是最早试验钍循环的实验室之一。他们制造了一座熔盐反应堆来试验这个技术的可行性。由于缺少经费这个项目于1976年停止。
印度拥有大量的钍矿,因此计划在未来完全仅依靠钍作为其核燃料,将铀完全排挤掉。这个雄心勃勃的计划包括快中子和热中子增殖反应堆。
2007年挪威考虑是否将精力集中在钍循环上。
钍造影剂
从1931年至1940年代末一种稳定的、胶质的二氧化钍混悬剂在血管攝影被作为放射性对比剂使用。但是这个用剂会聚集在微血管中,导致局部放射性过高和癌症。胆癌明显与钍造影剂有关,钍造影剂还能引发一般非常少见的恶性肝脏癌症肝血管肉瘤。此外还有钍造影剂导致鼻腔癌的纪录。一般病发发生在使用30至35年后。今天人们使用硫酸钡和改善的、有香味的碘化合物取代钍造影剂。
其它应用
为了改善钨惰性气体焊接电极产生火花的性能其电极掺入1至4%的氧化钍。为了降低电子功函数放电灯的钨丝掺有1-3%的二氧化钍。在造灯业中氧化钍还以薄膜或者薄片的形式作为收气剂。由于二氧化钍的折射率比较高,因此在高质量的光学透镜中也掺有钍。
安全
钍的化学毒性估计非常小。它的危险性主要来自其放射性。钍毒性小的原因在于纯钍及其最常见的氧化物的水溶性非常小,在一升水中只能溶0.0001微克的纯钍。只有在酸性非常高、pH值低于4的溶液中它的可溶性才提高。此外草酸也可以提高钍的水溶性。
放射性
钍同位素232Th的半衰期为140.5亿年,它的放射性比铀238还要低。原因是因为由于它的半衰期高,因此它每秒钟衰变的次数少,此外它衰变产物中半衰期比较低的也比较少。钍放射α粒子,因此它被吸入或者食入的话危险比较高。尤其粉状的金属和氧化物能够进入肺,非常危险,会致癌。此外在放置钍和它的化合物的时候要注意它的衰变产物亦可能有放射性,如208Tl可以放射出260万电子伏特的伽马射线。
化合物
按照其在元素周期表中的位置钍在它的化合物中一般以正四价出现,正三价和正二价比较少见。而其盐的溶液中,只存在正四价的钍离子。一个特殊点是锕系元素没有固定整比的碳化合物。
二氧化钍(ThO2)是所有金属氧化物中熔点最高的,达3300摄氏度。只有少数金属如钨和少数化合物如碳化钽的熔点比它高。
硝酸钍(Th(NO3)4)是一种无色的、容易在水和酒精中溶解的化合物。硝酸钍是制造二氧化钍和金属钍过程中的一个重要环节,在制造白炽罩的过程中也有应用。
氮化钍(Th3N4)由炽热的钍与空气中的氮反应而成,有青铜光泽。在空气中它与水汽反应在数小时内分解。
碳化钍(ThC2)是黄色的晶体,其熔点为2655摄氏度。碳化钍在约9K时超导。碳化铀和碳化钍的混合物在高温反应堆中作为燃料。这种燃料是将钍和铀的氧化物与碳混合加温到1600至2000摄氏度制成的。
参考
^ Magnetic susceptibility of the elements and inorganic compounds 互联网档案馆的存檔,存档日期2011-03-03., in Handbook of Chemistry and Physics 81st edition, CRC press.
^ Emsley J. The Elements, 1992, Clarendon Press Oxford
^ K.M.V. Jayaram. An Overview of World Thorium Resources, Incentives for Further Exploration and Forecast for Thorium Requirements in the Near Future (PDF). (原始内容 (PDF)存档于2007-11-28).
^ U.S. Geological Survey, Mineral Commodity Summaries - Thorium.
^ Information and Issue Briefs - Thorium. World Nuclear Association. [2006-11-01].
^ IAEA: Thorium fuel cycle -- Potential benefits and challenges (PDF). : pp 45(table 8), 97(ref 78). 引文格式1维护:冗余文本 (link)
參考文獻
.mw-parser-output .refbegin{font-size:90%;margin-bottom:0.5em}.mw-parser-output .refbegin-hanging-indents>ul{list-style-type:none;margin-left:0}.mw-parser-output .refbegin-hanging-indents>ul>li,.mw-parser-output .refbegin-hanging-indents>dl>dd{margin-left:0;padding-left:3.2em;text-indent:-3.2em;list-style:none}.mw-parser-output .refbegin-100{font-size:100%}
Wickleder, Mathias S.; Fourest, Blandine; Dorhourt, Peter K. Thorium. (编) Morss, Lester R.; Edelstein, Norman M.; Fuger, Jean. The Chemistry of the Actinide and Transactinide Elements 3rd. Springer Science+Business Media. 2006. ISBN 1-4020-3555-1. 引文使用过时参数coauthors (帮助)
延伸閱讀
Martin, Richard. Super Fuel: Thorium, the Green Energy Source for the Future 1st. Palgrave Macmillan. 2012: 240. ISBN 978-0-230-11647-4 (hardback) 请检查|isbn=值 (帮助).
Hargraves, Robert. Thorium: Energy Cheaper than Coal. CreateSpace Independent Publishing Platform. 25 July 2012: 482. ISBN 978-1478161295.
外部連結
维基共享资源中相关的多媒体资源:钍 |
| 查询維基詞典中的thorium。 |
- International Thorium Energy Organisation – IThEO.org
- European Nuclear Society – Natural Decay Chains
- ATSDR CDC ToxFAQs: health questions about thorium
FactSheet on Thorium, World Nuclear Association- Thorium TV – A review of the element
- EnergyFromThorium.com – Content-rich site on Thorium as a future energy source, and its extraction technology
- TED talk by former NASA engineer Kirk Sorensen about Thorium energy production (video)
- India's experimental Thorium Fuel Cycle Nuclear Reactor (NDTV Report)
- Thorium Remix 2011 – 120 minute Creative Commons Share-Alike documentary on Thorium as an energy source
- Newspaper article about thorium power in India
- China Blazes Trail for Clean Nuclear Power from Thorium
Thorium at The Periodic Table of Videos (University of Nottingham)
Thorium Deposits of the United States—Energy Resources for the Future? (USGS, 2009)- 钍
元素周期表(锕系元素) | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| | IA 1 | IIA 2 | IIIB 3 | IVB 4 | VB 5 | VIB 6 | VIIB 7 | VIIIB 8 | VIIIB 9 | VIIIB 10 | IB 11 | IIB 12 | IIIA 13 | IVA 14 | VA 15 | VIA 16 | VIIA 17 | VIIIA 18 | ||||||||||||||||||
1 | H | | He | |||||||||||||||||||||||||||||||||
2 | Li | Be | | B | C | N | O | F | Ne | |||||||||||||||||||||||||||
3 | Na | Mg | | Al | Si | P | S | Cl | Ar | |||||||||||||||||||||||||||
4 | K | Ca | | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | |||||||||||||||||
5 | Rb | Sr | | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | |||||||||||||||||
6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | ||||
7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | ||||
| ||||||||||||||||||||||||||||||||||||
|

